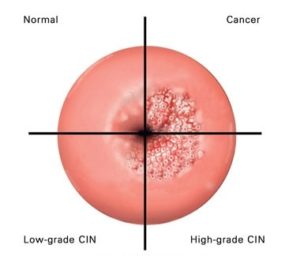
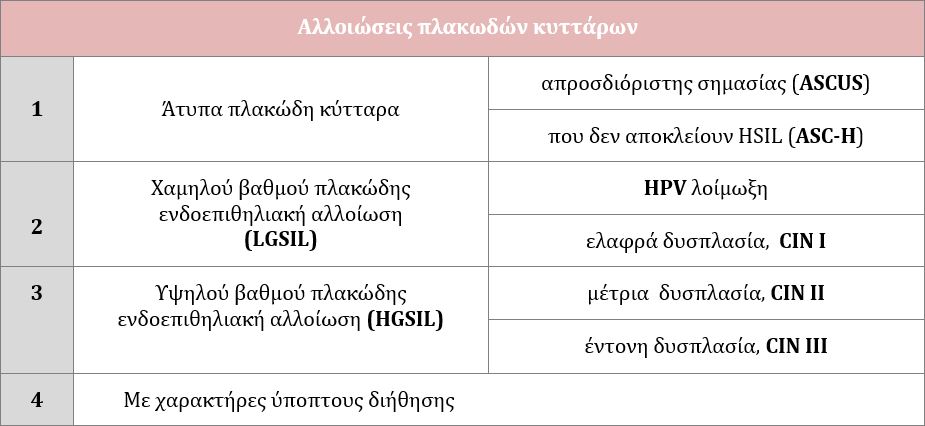
Ο ιός HPV (Human Papilloma Virus ή ιός των ανθρωπίνων θηλωμάτων) είναι ένας DNA ιός o οποίος μπορεί εν δυνάμει να προσβάλλει τα επιθηλιακά κύτταρα του δέρματος και των βλεννογόνων των ανθρώπων και ορισμένων ζώων. Μέχρι στιγμής έχουν αναγνωρισθεί πάνω από 190 διαφορετικά στελέχη του ιού, εκ των οποίων τα 120 μπορούν να προσβάλουν τον άνθρωπο. Από αυτά, περίπου τα 40 μεταδίδονται μέσω της σεξουαλικής επαφής, μολύνουν την περιοχή των γεννητικών οργάνων, ενώ διακρίνονται σε υψηλού και χαμηλού κινδύνου ανάλογα με την δυνατότητά τους να προκαλέσουν την ανάπτυξη προκαρκινικών ή καρκινικών αλλοιώσεων.